
動脈硬化により足の血管が狭くなったり詰まったりする障害向けの遺伝子治療薬「コラテジェン」を開発しているアンジェスはこのほど、2026年内にも米国で同薬の承認申請する方針を明らかにした。
症状が重いと「重症虚血性下肢」などと呼ばれ、足の血流が不足し、安静時の痛みや潰瘍につながり、足の切断に至ることもあるという。同社の創業者で、現在メディカルアドバイザーを務める森下竜一氏は、日本で発見されたHGF(肝細胞増殖因子)遺伝子を活用し、血管再生を促す薬剤が、これまで治療法が限られていた難病患者に新たな希望をもたらすと胸を張る。
森下氏に、米国での良好な臨床試験結果とFDAの迅速承認への期待、そして日本市場が抱える薬価制度の課題について聞いた。

■アメリカでの臨床結果と承認申請への道
──アンジェスが開発した足の血流障害向けの遺伝子治療薬について、2026年にアメリカで承認申請予定だそうですね。
森下 ええ。今回アンジェスが開発しているのは、商品名「コラテジェン」という血管再生治療薬で、日本で発見された肝細胞増殖因子(HGF)という血管再生・増殖因子を遺伝子の形で体内に投与し、局所で血管を再生することによって足の潰瘍を治療するものです。
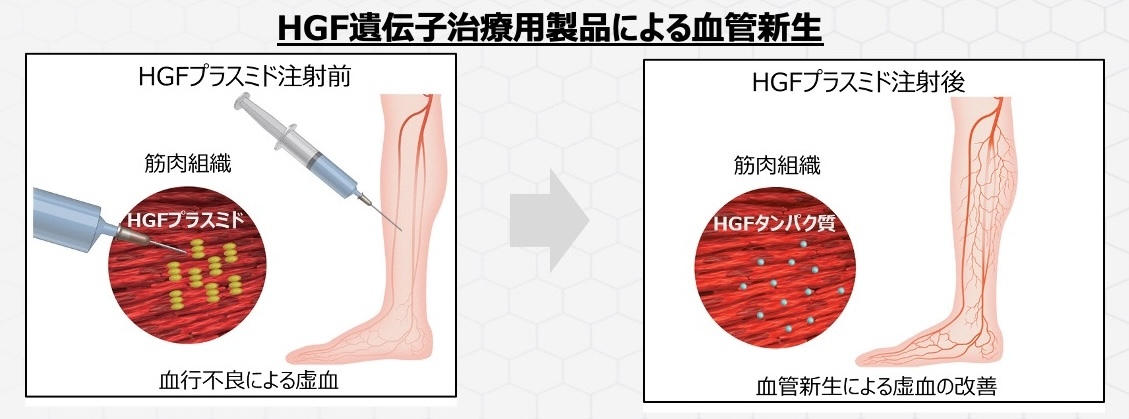
具体的には、閉塞性動脈硬化症という病気があります。これは全身の動脈硬化の一種で、心臓で起きれば心筋梗塞、脳で起きれば脳梗塞になりますが、足で起こった場合は閉塞性動脈硬化症と呼ばれます。
軽症時はしびれや間欠性跛行(少し歩くと足が痛くなり歩けなくなる状態)が見られますが、重症化すると安静時にも痛みが続き、さらに悪化すると潰瘍ができ、治りにくくなります。このような状態になると、治療法がない場合、足の切断に至ったり、場合によっては死に至ったりすることもある、癌とほぼ同程度の死亡率が高い重篤な病態です。
これまではバイパス手術やバルーン療法といった治療法がありましたが、それらが適用できない方や、手術をしても再発を繰り返す難治性の病気でした。
コラテジェンは、血管を作る肝細胞増殖因子(HGF)の遺伝子をプラスミドDNAという安定した形で筋肉内投与することで、足の局所で血管を再生していく治療法です。
──今回、アメリカで非常に良い結果が出たとのことですが、具体的にどのような試験だったのでしょうか。
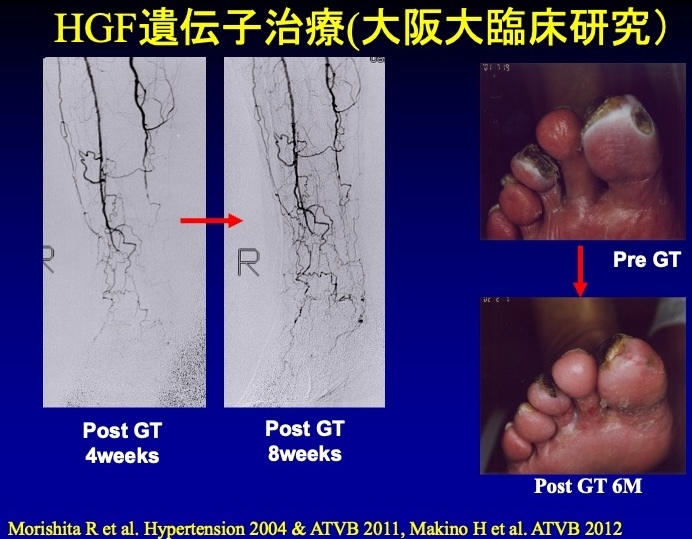
森下 プラセボ(偽薬)とコラテジェンを投与し、潰瘍が完全に治癒するかどうかをエンドポイントとして試験を行いました。その結果、プラセボに対してコラテジェンが有意に潰瘍の治癒率を向上させることが確認されました。
この結果を受け、アメリカの厚生労働省にあたるFDA(食品医薬品局)と協議したところ、今まで治療方法のない重篤な疾患に対する試験で非常に良好な結果であること、そして過去の安全性データからも極めて安全であることが評価されました。これにより、いわゆる第3相試験(※)を省略し、医薬品として承認申請を進めて良いという結論に至りました。現在、2026年の承認申請に向けて準備を進めています。
※…新薬の開発における臨床試験(治験)の最終段階。多数の患者に対し、薬の有効性と安全性を検証、既存薬やプラセボと比べて科学的証拠を確立する
先週、欧州の大手製薬企業ベーリンガーインゲルハイム社と製造に関する提携を結びました。FDAは製造体制がしっかりしているか、そして必要な患者さんに薬が確実に届く供給能力があるかを非常に重視しています。
アメリカには重症の閉塞性動脈硬化症で潰瘍がある方が約50万人いらっしゃいますが、FDAは最低でもその1割の方には供給して欲しいと考えているようです。
ベーリンガーインゲルハイム社との提携により、この大規模な製造・供給体制を整えることができ、承認申請に向けた準備が完了しつつあります。
■大学発ベンチャー・アンジェス設立の背景と日本市場の課題
──アンジェスは1999年に設立されたとのことですが、当初はどういう開発をされていたのでしょうか。
森下 アンジェスは私が創業した会社で、1990年代半ばにHGFが血管再生を促すことを発見し、これを治療法に応用するため、1999年に大学発ベンチャーとして立ち上げました。
2002年には東証マザーズに大学発ライフサイエンスベンチャーとして初めて上場し、臨床試験に必要な資金を調達しました。当時は赤字上場であり、前例のない挑戦でした。

設立当初、遺伝子治療は非常に新しい分野であり、主な対象は、癌や遺伝病といった命に関わる病気でした。閉塞性動脈硬化症も重症化すれば命を脅かしますが、生活習慣病という側面もあり、当初は最も重症で他に治療法がない限られた患者さんを対象に試験を行っていました。
日本でも今回のアメリカでの試験と同様に、プラセボとの比較試験で潰瘍の縮小率に効果が認められ、2019年に期限付き承認を得ました。
しかしその後、コロナワクチンの登場により状況は大きく変わりました。メッセンジャーRNAワクチンやアデノウイルスワクチンも遺伝子治療の一種であり、これまで数十万人規模だった遺伝子治療が、一気に数億人規模で実施されたことで、遺伝子治療へのハードルが大きく下がったのです。
この変化を受け、アメリカでは他に治療法がない重症閉塞性動脈硬化症の潰瘍患者さんを軽症の方も含め、対象を拡大し、コラテジェンを投与し、効果を検証することになりました。これにより対象患者数が大幅に拡大し、投与回数も日本での2~3回から最大4回へと増えました。
その結果が非常に良好だったため、マーケットが小さかった日本よりも、アメリカの大きなマーケットを優先する開発方針に変更し、日本での承認申請を取り下げました。
──日本の薬価制度が開発方針に影響を与えたのでしょうか。
森下 日本の薬価制度には課題があります。
アメリカで薬価が設定されると、バイパス手術やバルーン療法と同等かそれ以上の価格、少なくとも7万5000ドル(約1000万円以上)が見込まれます。注射だけで治療できることを考えると、妥当な価格です。アメリカの市場規模は日本の20倍以上であり、薬価もはるかに高いため、アメリカを優先する判断に至りました。
日本の薬価は、海外で承認された薬の場合、海外の薬価を参考に決定されます。
しかし、新しい薬については原価積み上げ方式が採用され、厚生労働省が費用を調整する傾向があります。会社が算出した費用が300万~400万円であっても、試験と直接関係ない費用として大幅に削減され、結果的にアメリカの10分の1程度の薬価になることもあります。
このような制度では、革新的な医薬品の開発が阻害される可能性があります。
■日本の医薬品承認フローの課題、将来は欧米市場を中心に
──日本とアメリカの承認フローにはどういう違いがあるのでしょうか?
森下 日本の場合、通常、プラセボとの比較試験を2回実施することが求められます。しかしアメリカでは、今回のように非常に良好な結果が得られれば、追加の試験は不要と判断されることがあります。日本の制度は形式にとらわれがちで、柔軟性に欠ける側面があります。
また、日本で一度保険適用されると、偽薬との比較試験が倫理的に困難になるという問題もあります。患者さんは当然、本物の薬を希望するため、比較試験の対象となる患者群の選定が難しくなります。
このような状況下では、柔軟な対応ができなければ、開発が滞る原因にもなります。

──今回アメリカで承認を取り、流通された後、日本での展開は視野に入れているのでしょうか。
森下 アメリカでBLA(生物学的製剤承認申請)制度を用いて承認申請を行い、約1年で承認されると見込んでいます。その後、アメリカのデータを流用して日本国内での承認申請を行うことも視野に入れています。
しかし、マーケットサイズと薬価を考慮すると、アメリカ市場が圧倒的に大きいため、コラテジェンを他の疾患に応用し、最大限の価値を生み出すことに注力したいと考えています。
日本で初めて開発された遺伝子治療薬として、血管再生や循環器分野で世界的に展開していくことが重要です。欧州をはじめ、マーケットの大きい地域を中心に開発を進めていくことになるでしょう。
現在、販売についても大手製薬企業との協議を進めています。アンジェスとしては、遺伝子治療のグローバルリーダーを目指し、日本発の遺伝子治療を世界に広げていきたいと考えています。
コラテジェンが重症虚血性下肢疾患の潰瘍治療薬として承認された後は、プラスミドDNAという安全な方法の効率をさらに高め、より安全で有効性の高い遺伝子治療を追求していきます。
長期的には、遺伝子治療や癌治療に限らず、AIやヘルステックといった分野への挑戦も可能性としてあります。企業価値を高めることで、日本発の技術を継続的に世界に広げ、買収されることなく独立した存在感を確立してもらいたいと考えています。
コラテジェンの承認申請について大きな問題は今のところ想定されていない。にもかかわらず、そのニュースが出た今も株価は急上昇せず低迷している。
世界の通例を踏まえると、アンジェスのような創薬ベンチャーは承認申請の段階で大手製薬会社に買収されるケースが少なくない。
日本発のバイオベンチャーであるからこそ、海外から買収されることなく日本で輝いてほしい。