医薬品の条件のジレンマ
創薬は、「シード化合物」という、スタートとなる化合物から始まる。どのシード化合物から始めるか。シード化合物の化学構造をどのように変えていくか。これらの選定が、成功のカギとなる。しかし、前章でみたさまざまな条件は、ある種のジレンマとなって、創薬に立ちはだかることとなる。
●医薬品の条件には相反するものがある
創薬においては、分子量、水溶性、脂溶性などの条件を満たすことが化合物に求められる。しかし、これらの条件には相反するものがある。諸条件を適度に満たす、バランスのよい化合物が求められる。
(1) 分子量
化合物が小さければ、細胞膜の通過や、血液脳関門の通り抜けに有利となる。一方、大きなタンパク質に結合して、その働きを制御するためには、大きな分子のほうが好ましい(8)。
(2) 水溶性・脂溶性
体内での患部までの運搬を考慮すると、水溶性をもつことが重要である。一方、細胞膜の通過や、血液脳関門の通り抜けを考えると、脂溶性が求められることとなる。
-----------------------------------
(8)細胞膜の通過と、大きなタンパク質の制御を兼ね備えた医薬品として、ペプチド医薬、核酸医薬といった、分子量500~6,000程度の中分子医薬の開発が進められている。
●医薬品の条件をまとめた経験則がある
創薬のための経験則として、1997年にファイザー社の医薬品化学者リピンスキーが発表した「ルール・オブ・ファイブ」(9)が有名である。全部で4つのルールからなり、これらを満たす化合物は、経口投与したときに生体膜を通過しやすく、薬効が示される可能性が高いとされる。これらのルールは、多くの化合物の中から医薬品候補を探す目安として有効であり、創薬現場で広く受け入れられている。
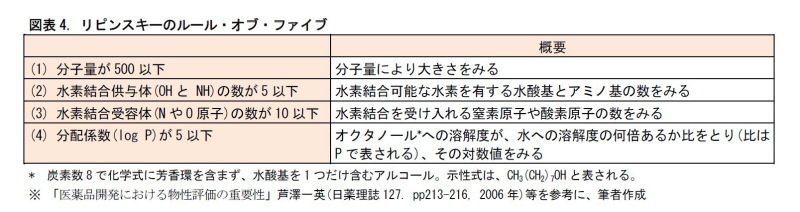
なお、この経験則にとらわれ過ぎてしまうと、革新的な創薬に支障をきたすこともある。たとえば、創薬の前提となる、経口投与は本当に必要なのか。大きい分子量でも、環状構造などの分子構造によって細胞膜の通過を期待できないか。など、柔軟な発想で、創薬に取り組む必要がある。
-----------------------------------
(9)ルールに表れる数字がいずれも5の倍数であるため、このような名前で呼ばれている。
創薬における新技術
従来より、創薬では「ハイスループットスクリーニング」という方法が行われてきた。これは、医薬品の候補である膨大な種類の化合物に対して、多くの構造変換を行って、ターゲットのタンパク質への結合や調整の可否を調べていくものであった。この方法は、いわば、数撃てば当たる式のもので、研究者の経験や勘に基づいて、試行錯誤を繰り返すものであり、創薬の効率性は低かった。
現在は、プロドラッグ、SBDD、コンビケムといった新たな創薬技術が導入され、創薬の効率性が高まりつつある。少し、みていくこととしよう。
●プロドラッグ : 体内で代謝を受けて医薬品に変わる
投与した医薬品が、酵素の代謝を受けたり、膜を通過できない事態を回避したい。そこで、血液中の濃度を安定させたり、膜を通過したりするために、あえて化合物の構造を変えて投与することがある。これは、医薬品の前段階という意味で、「プロドラッグ(医薬前駆体)」と呼ばれている。
プロドラッグは、血中濃度が安定したり化合物が膜を通過したりした後に、酵素の代謝によって、活性を示す構造に変わる。つまり、酵素による代謝を逆手にとった技術といえる(10)。この技術により、脂溶性の増大、作用の持続化、毒性・副作用の軽減、安定性の改善などが図られる。
-----------------------------------
(10)よく用いられるのは、膜を通過しにくいカルボキシル基を含む化合物(R-COOH)を、脂溶性の高いエステル結合(R-CO-O-R')を持つプロドラッグの形に変えて投与する方法。投与されたプロドラッグは、肝臓で代謝を受けると、エステル結合が切断されて、カルボキシル基が現れ、医薬品としての活性を示すようになる。
●SBDD : タンパク質の構造にあわせて医薬品を設計
前もって、ターゲットとなるタンパク質の構造を分析して、それに適した創薬を行う方法がある。これは、「SBDD (Structure-Based Drug Design, 分子立体構造に基づく薬物設計) 」と呼ばれている。
SBDDでは、まず、X線を用いて、ターゲットのタンパク質の結晶構造解析を行う。従来は、タンパク質の結晶化が困難で解析できなかった。近年、その技術が進歩したことが、SBDD実用化の背景にある。タンパク質の構造がわかれば、効果がありそうな化合物の構造変換を、予想することができる。
さらに、実際に化学反応をさせる(試験管内(in vitro) スクリーニング)前に、タンパク質の結晶構造と医薬品候補の化合物のデータをもとに、コンピュータ上で仮想実験を行う「シリコンチップ内(in silico) スクリーニング」という方法も行われている。
ただし、SBDDには限界がある。タンパク質の結晶化は、現在もなお困難な技術で、膨大な種類のタンパク質の結晶構造の解析は道半ばとされている。また、そもそも生体内(in vivo) では、タンパク質が結晶の形に固定されたものとは異なり、結晶構造を解析しても無意味となる可能性もある(11)。
-----------------------------------
(11)このため、核磁気共鳴スペクトルなどの方法で、タンパク質を結晶化させずに溶液中で解析を行う方法も進められている。
●コンビケム : 創薬の詰めの段階で網羅的に化合物を合成
多くのバリエーションが考えられる化合物を、いっぺんに多種類合成する手法もある。これは、「コンビケム(組合せ化学)」と呼ばれている。ポリスチレンなどの固体の表面に化合物を結合させていく「固相合成」の技術が応用される。
合成したい化合物がいくつかのパーツから成り、各パーツにはいくつかの種類が考えられるとする。コンビケムにより、各パーツに、考えられるすべての種類を持たせた化合物を合成することができる。

このコンビケムにも、限界がある。固相合成の際にできる副生成物の除去が困難で、合成作業を繰り返すうちに、さまざまな種類の副生成物ができてしまう。コンビケムは、ある程度、医薬品候補の化合物の絞り込みができた段階で、最後の詰めの作業として用いられることが一般的とされている(12)。
-----------------------------------
(12)洋服でいえば、SBDDは体に合わせて作る「オーダーメイド型」、コンビケムはさまざまなタイプやサイズを揃えた中から選ぶ「レディメイド型」といえる。レディメイド型では、ある程度タイプやサイズを絞りこんだ状態でないと、網羅的に用意することは難しい。いずれも「試着」にあたる臨床試験により、医薬品としての効果と安全性の確認が必要となる。
(参考) ゲノム創薬に対する期待
現在、遺伝子情報をもとにした「ゲノム創薬」の研究が、世界中で精力的に進められている。ゲノム創薬は、幅広い内容を含んでいる。遺伝子情報をもとに、疾患関連の遺伝子を発見すること。ターゲットとなるタンパク質を特定すること。タンパク質に結合するシード化合物を選定すること。薬理研究により、化合物の働きを遺伝子レベルで確認すること、などである。今後、ゲノム創薬により、創薬の効率性は高まるものとみられる。個別化医療や精密医療への応用も、期待されている。
おわりに (私見)
今後も世界中の医薬品メーカーで、ゲノム創薬をはじめ、さまざまな新技術を用いた医薬品づくりが進められるものと思われる。ただし、引き続き、創薬には多くの困難さが伴うであろう。1年間につくられる医薬品の品目数が、劇的に増えることは考えにくい。医薬品は、患者の生命やQOL の動向に直結するものであるため、薬効とともに、厳しい安全性を確保することが求められるからである。
一般の側からは、新たな医薬品の登場を過度に期待したり、無闇に医薬品の安全性に疑問を抱いたりせずに、創薬の動向を見きわめる必要があろう。引き続き、その動向を注視することとしたい。
篠原拓也(しのはら たくや)
ニッセイ基礎研究所 保険研究部 上席研究員・ヘルスケアリサーチセンター兼任
【関連記事 ニッセイ基礎研究所より】
・ジェネリック(後発薬)とは、どういうものなの?
・保険適用になる薬と、ならない薬では、薬効、安全性、流通の仕方がどう違うの?
・後発医薬品の普及-調剤医療費の増加は抑制できているか?
・日銀の金融緩和策にふさわしいETFはどれか
・市場参加者が考える回収率はどれくらい?